Compostos orgânicos: Isomeria plana e espacial
A diferença está nos detalhes
A versatilidade do carbono faz com que a isomeria seja um fenômeno comum entre os compostos orgânicos
Quando discutem a possibilidade de encontrarmos vida fora da Terra, a maioria dos astrobiólogos concorda em um ponto: qualquer ET deve ter organismo composto fundamentalmente de carbono, como os seres vivos da Terra. Por quê? Ora, porque o carbono é o elemento mais versátil de todos os elementos químicos existentes no Universo.Por serem tetravalentes (apresentarem quatro elétrons na última camada), o carbono é capaz de formar cadeias estáveis com outros elementos – principalmente com o hidrogênio e o oxigênio.
Essa mesma versatilidade dá aos compostos orgânicos outra característica: existem entre eles muitos compostos isômeros. Isomeria é o fenômeno no qual dois ou mais compostos têm a mesma fórmula molecular, mas diferentes fórmulas estruturais. Isômeros têm os mesmos elementos químicos, na mesma quantidade, mas apresentam propriedades diferentes porque os átomos se unem de maneira diferente.
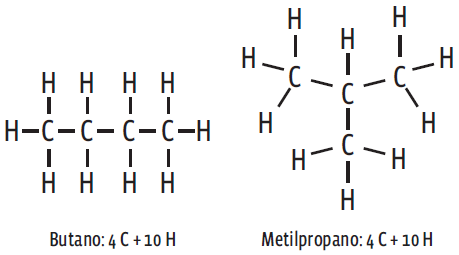
São isômeros, por exemplo, o butano e o metilpropano.A fórmula molecular de ambos é C4H10. No entanto, a forma das ligações é bem diferente. Repare na disposição dos átomos de C e H nos dois compostos:
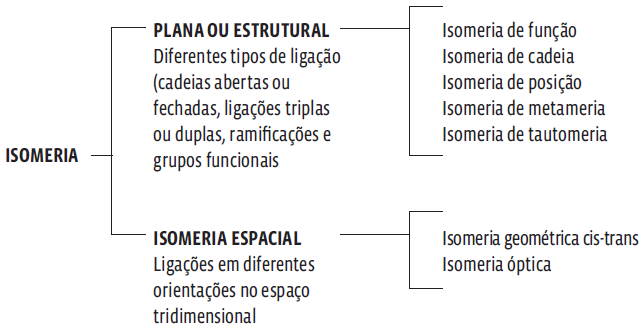
Existem duas grandes categorias de isomeria: plana (ou estrutural) e espacial. Na isomeria plana a diferença está, fundamentalmente, na combinação dos átomos – quem se liga a quem. E essa forma é percebida na fórmula estrutural. A isomeria espacial é aquela na qual as diferenças estão na distribuição dos átomos no espaço real, com suas três dimensões. Essas duas categorias se dividem em diversos subtipos. Veja no esquema abaixo.
Isomeria plana
As diferenças aparecem na fórmula estrutural plana – aquela que você lê nos livros ou escreve no caderno. As diferentes ligações entre os átomos de dois compostos isômeros definem distintas funções orgânicas, tipos de cadeias ou posições. Os tipos de isomeria plana são:
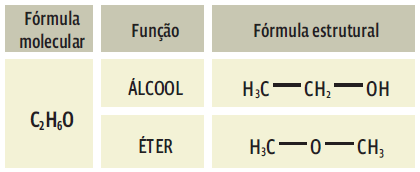
-> Isomeria de função: os isômeros pertencem a funções distintas. Veja dois exemplos:
-> Isomeria de cadeia: os isômeros pertencem à mesma função, mas apresentam diferentes tipos de cadeia.
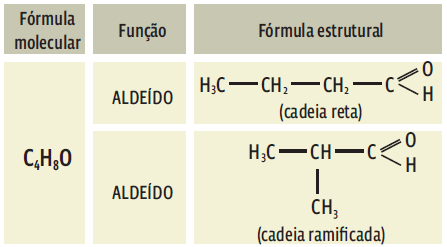
-> Isomeria de posição: os isômeros pertencem à mesma função e têm os mesmos tipos de cadeia, mas apresentam diferença na posição de um grupo funcional, de uma ramificação ou de uma insaturação.
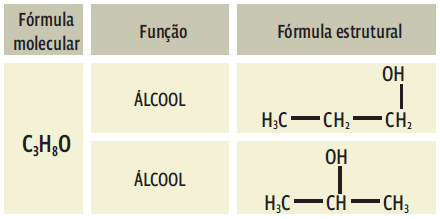
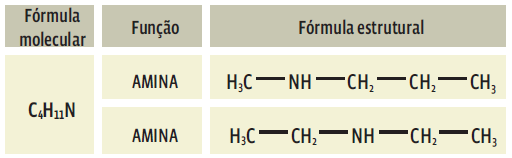
-> Isomeria de compensação (metameria): os isômeros pertencem à mesma função e têm o mesmo tipo de cadeia, mas apresentam diferença na posição dos átomos de qualquer elemento, afora o C e o H. Por exemplo, o oxigênio e o nitrogênio.
Tautomeria (ou isomeria dinâmica): dois compostos colocados em contato entram em equilíbrio químico. O aldeído e o enol, por exemplo, têm a mesma fórmula molecular, C2H4O. Qualquer um deles, no estado líquido, ou em solução, se transforma no outro, em equilíbrio dinâmico.
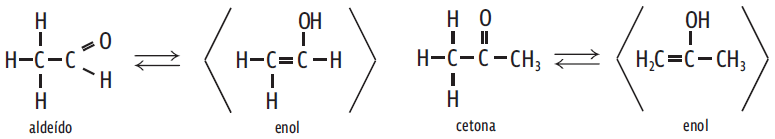
Isomeria espacial
As moléculas são estruturas tridimensionais, com os átomos se ligando em diferentes orientações e ângulos. Essa diferença na orientação define a isomeria espacial, ou estereoisomeria,e só é identificada pela análise da estrutura espacial do composto. Existem diversos tipos de isomeria espacial:
-> Isomeria geométrica: os compostos apresentam insaturação por dupla ligação e cada um dos carbonos dessa dupla está ligado a um átomo ou grupo de átomos diferente. Veja a diferença:
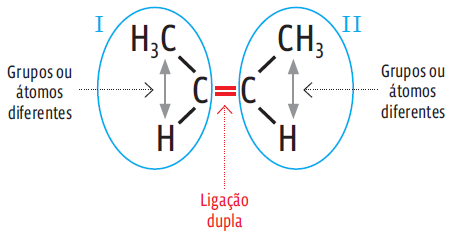

isomeria geométrica tem outra subdivisão – “cis”ou “trans”. O Enem não costuma pedir que você identifique essas variações, mas é bom saber que elas existem, para não se confundir nos enunciados. Sempre que se falarem “cis” ou “trans”,trata-se de isomeria geométrica.
Repare:
• Há dois C em ligação dupla;
• Cada C está associado a dois grupos ou átomos diferentes (em I, a H3C e H; em II, a CH3 e H)
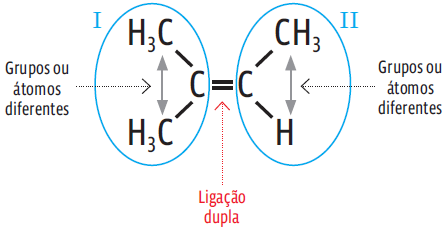
Já no composto abaixo, apesar de apresentar a dupla ligação, um dos C apresenta dois ligantes iguais (CH3) e, por isso, não apresenta isomeria geométrica.
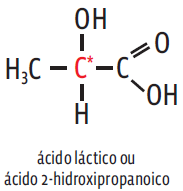
-> Isomeria óptica: a molécula tem, pelo menos,um carbono assimétrico (ou carbono quiral)– um C ligado a quatro grupos diferentes entre si. Os carbonos assimétricos são assinalados nas fórmulas estruturais com um asterisco. Veja: