Professor, estou com dúvida sobre entalpia. Diz no livro (não estou indo a um cursinho) que no cálculo de uma reação de entalpia devo usar esta fórmula ΔH = ΔHp – ΔHr (variação = delta dos produtos MENOS o delta dos reagentes). Mas a LEI DE HESS diz que é ΔH = ΔHp+ ΔHr. Aí está a minha confusão. Quando vou fazer exercícios coloco a lei de Hess, e às vezes acerto e às vezes erro. Gostaria de saber MUITO, muito mesmo, quando usar uma ou outra.
Enviado por Maicon
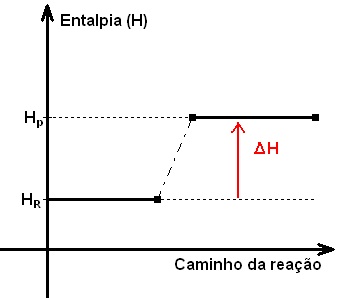
Maicon, a variação de entalpia corresponde ao calor liberado ou absorvido em qualquer processo físico ou químico (a uma pressão constante) e é dado por ΔH = ΔHfinal – ΔHinicial, onde para uma reação o estado inicial é dado pelos reagentes e o estado final, pelos produtos. Sendo assim, ao tratar de uma reação química, conhecendo-se os valores de ΔHp e ΔHr, sempre se usa ΔH = ΔHp – ΔHr. Lembrando que a quantidade de calor de um processo (ΔH) é diretamente proporcional à quantidade de matérias (mols) de seus participantes.
Existem reações em que é muito difícil medir o ΔH da reação experimentalmente, por exemplo, em reações explosivas, e para estes casos, a Lei de Hess se aplica. É um método para calcular ΔH de uma reação sem necessariamente realizar esta reação, ou seja, com base na variação de entalpia de reações intermediárias. Tem-se então que a variação da entalpia de uma reação é igual à soma das variações de entalpia das etapas intermediárias, ou seja, ΔH = ΔH1 + ΔH2, aceitando-se duas reações intermediárias (1 e 2).
Resumindo: a variação de entalpia de uma reação é dada por ΔH = ΔHp – ΔHr, e este cálculo é aplicado quando se sabe as variações de entalpias dos produtos (ΔHp) e dos reagentes (ΔHr). Já a Lei de Hess é aplicada para o cálculo da variação de entalpia de uma reação com base em variações de entalpias de reações intermediárias, ou seja ΔH = ΔH1 + ΔH2.
*Respondido pelo professor de Química do Cursinho do XI, Jefferson Muniz Rocha.
Leia mais:
– Resumo: Termoquímica
– Resumo de Química: Reações endotérmicas e exotérmicas
 SEGUIR
SEGUIR
 SEGUINDO
SEGUINDO




















